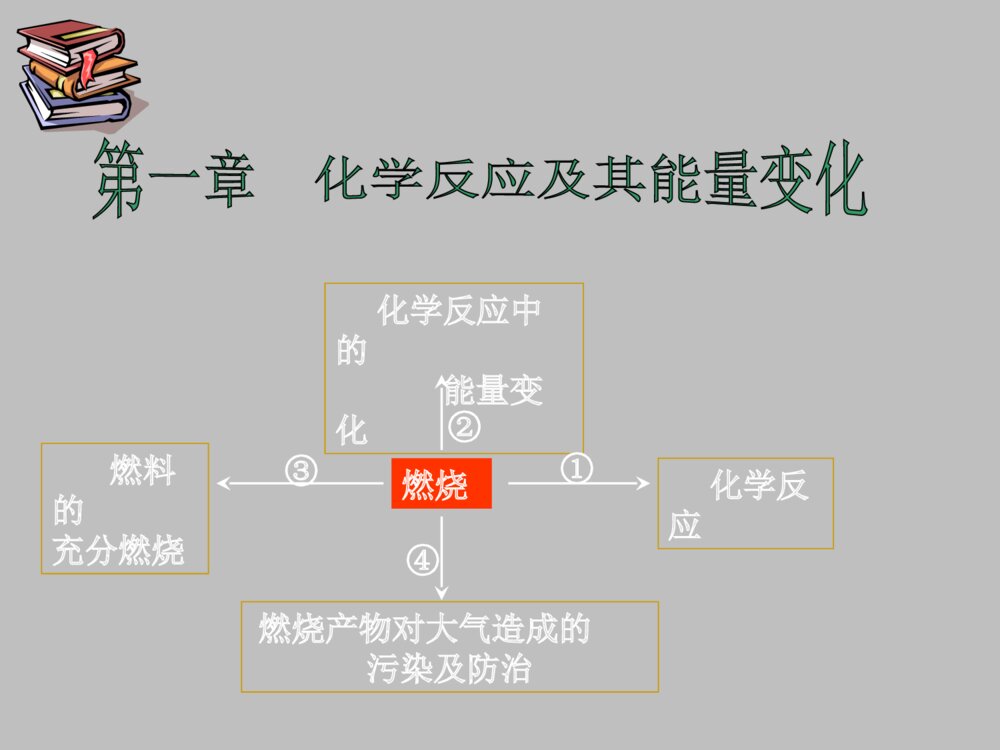
高一化学第一节化学反应及其能量变化PPT课件下载









试读已结束,还剩7页未读,您可下载完整版后进行离线阅读
《高一化学第一节化学反应及其能量变化PPT课件下载》是由用户上传到老师板报网,类型是化学课件,大小为402.5 KB,总共有17页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。更多关于请在老师板报网直接搜索
- 上一篇: 高考化学学科专题复习PPT课件下载
- 下一篇: 化学必修一实验室安全PPT课件下载













 赣公网安备 36010802000481号
赣公网安备 36010802000481号